文献解读 | NC期刊发表基于基因组组装揭示葱属进化和风味形成机制研究成果
葱属物种作为蔬菜、调味品或药用植物在全球范围内广泛种植。然而,葱属物种的基因组进化和独特风味形成的机制研究较少。
该研究报道了11.27 Gb的葱(Allium fistulosum)染色体水平基因组,结合转录组、代谢物检测等分析,多组学联合解析其巨大基因组及独特风味的形成机制。结合不同的葱属植物重测序数据,进行葱属物种的种群结构、传播路线等分析,揭示中国是葱的起源和驯化中心。该研究结果为葱属植物的基因组进化、风味形成和驯化历史提供见解,并为未来这些植物重要性状的分子育种提供强大基础。

文章题目:Chromosome-level genome assembly of bunching onion illuminates genome evolution and flavor formation in Allium crops
发表期刊:Nature Communications (IF= 17.694)
发表时间:2022.11.05
主要研究结果:
1、染色体水平的大型基因组组装和注释
该研究通过k-mer分析,预估葱基因组大小为11.97 Gb,杂合度为0.64%,重复序列比例为89.89%。PacBio测序获得1649.82 Gb数据(138.1×),结合Hi-C数据(95.1×)将初步组装结果挂载到8条染色体上,挂载率为98.71%,最终组装大小为11.27 Gb,contig N50为7.34 Mb。作者进一步对基因组进行评估,BUSCO为91%,QV值为37.06,LAI为24.81,Illumina数据一致性99.65%,表明组装的葱基因组完整性和准确性均较高。
表1 三种葱属植物的基因组组装特征
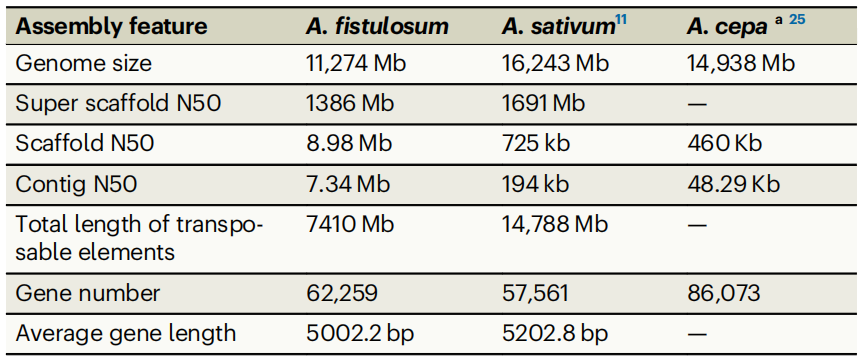
*A. fistulosum 葱;A. sativum 大蒜;A. cepa 洋葱
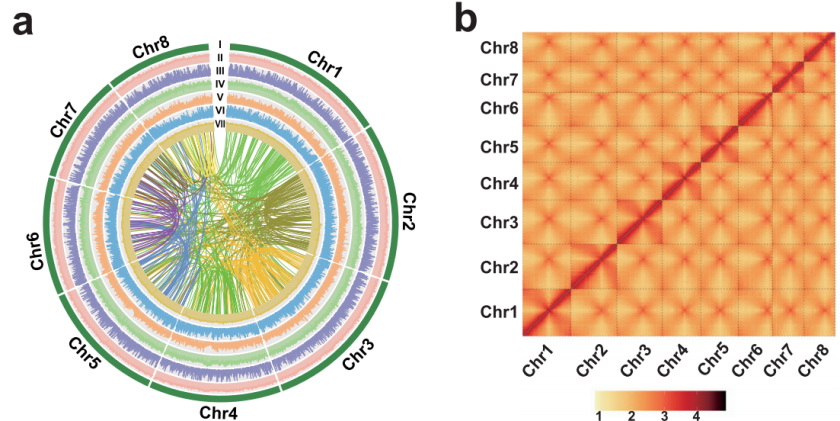
图1高质量的葱基因组组装
2、葱属植物基因组进化和染色体同源性
该研究选择了13个不同目、科的物种进行比较基因组分析,在这些植物中,3种葱属植物的总基因家族和特有基因家族数最多(图2a)。选用492个单拷贝基因家族构建进化树,结果表明葱(A. fistulosum)和洋葱(A. cepa)大约在7.4 MYA发生分化,二者共同祖先约在16.7 MYA与大蒜(A. sativum)发生分化(图2a)。对3个葱属植物中普遍发生扩张的基因家族进行GO富集分析,发现主要富集于催化活性、碳硫裂解酶活性等功能(图2b),说明葱属植物的高硫代谢活性是风味相关硫化合物生物成的原因。
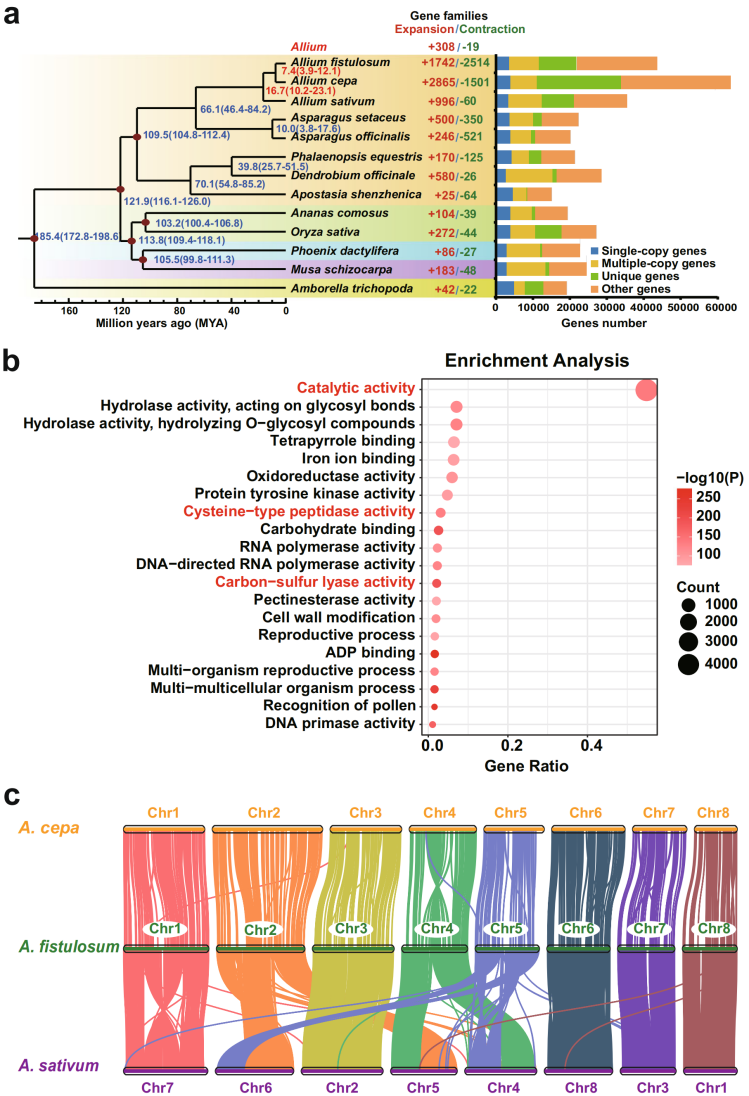
图2葱属植物的基因组进化及其亲缘关系
该研究对三种葱属植物进行共线性分析,发现A. fistulosum的四条染色体(Chr3,Chr6,Chr7和Chr8)与A. sativum(Chr2,Chr8,Chr3和Chr1)表现出几乎一对一的共线关系,其余4条染色体表现出几次重排。此外,在Chr1之间观察到明显的反转,以及其他染色体上的重排(图2c)。尽管三个葱属物种的基因组大小存在显著的差异,但三个葱属植物基因组的染色体共线关系较高,表明它们在进化上彼此相近。
3、深入了解基因组扩张和基因复制
葱属植物长期以来以其基因组较大而闻名。该研究发现,LTR是A. fistulosum基因组的主要组成部分,其中Gypsy占主要部分,并且在过去的200万年里爆发(图3a)。在Gypsy中,Tekey和Tat分支是A. fistulosum和 A. sativum基因组中最丰富的LTRs,CRM对LTR的贡献显著(10.38%)(图3b),虽然Copia LTRs在A. fistulosum和 A. sativum基因组中的比例很小,但其成分之间存在显著差异(图3a)。因此,LTRs的积累,特别是Gypsy的积累,是葱属植物基因组扩张的原因,而不同LTR分支的不均匀扩张导致了葱属植物基因组多样性。
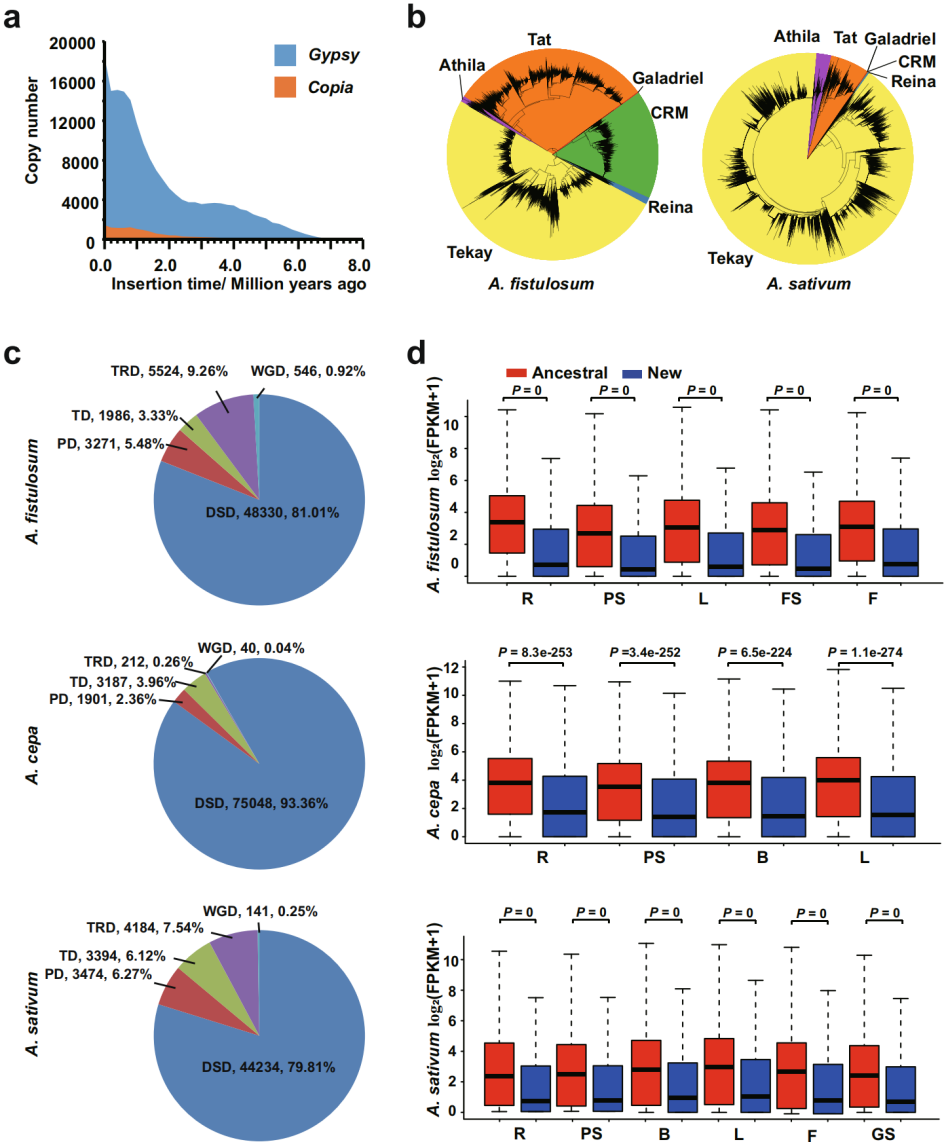
图3葱属植物中广泛的基因组扩张和基因复制
该研究发现,大基因组具有较高的散在重复(DSD)事件,表明DSD在大基因组的扩张中发挥了重要作用(图3c)。作者分析发现,葱属的祖先DSD基因表达水平显著高于新DSD基因(图3d),表达偏倚意味着基因复制后可能存在假基因化、亚功能化或新功能化,说明普遍存在的DSD事件导致了葱属植物基因组的基因扩张和分化。
4、风味相关的基因扩张与差异化
为了探究参与葱属植物风味形成基因的进化事件,作者在14个植物基因组中鉴定了所有与ACSO相关的基因(图4a)。编码ACSOs水解酶的ALL基因在三个葱属植物基因组中广泛扩张(图4a)。重要的是,在除葱属植物以外的物种中均未发现LFS基因(图4a,d)。作者根据LFS基因家族在三种主要葱属植物中的系统发育结构,将其分为LFS-a、LFS-b、LFS-c和LFS-d四组(图4d),发现LFS groups在不同物种中存在表达差异,A. fistulosum和A. cepa更倾向于表达LFS-c group成员,而A.sativum更倾向于表达LFS-a group成员(图4d)。
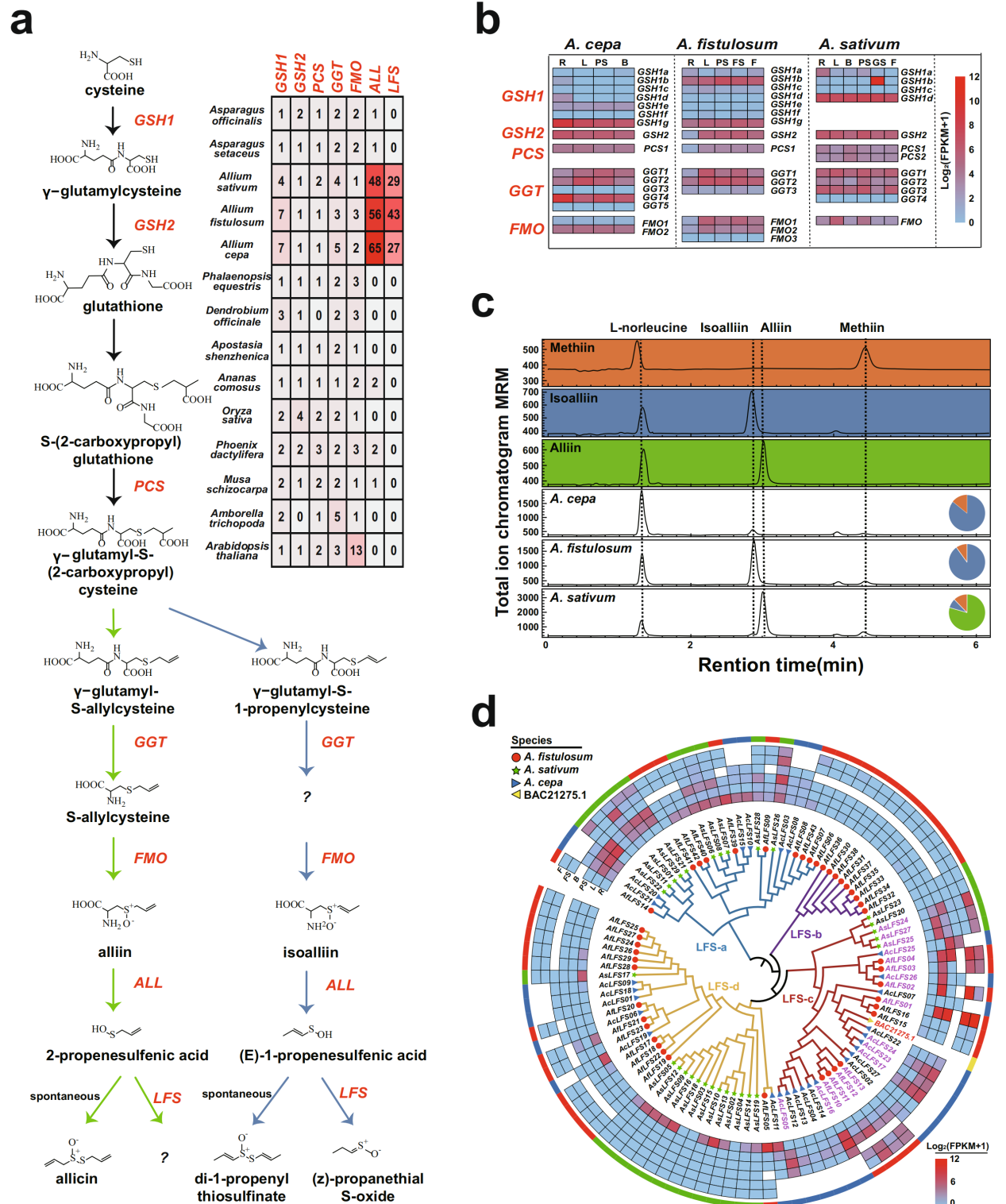
图4葱属植物中硫相关基因的大量复制和分化
此外,基因共线性分析表明,在葱和大蒜中,有几个LFS和ALL基因表现出一对多的关系(图5a,b)。因此,作者认为葱和大蒜在分化后LFS和ALL基因家族的独立扩张和分化可能与它们的风味多样性有关(图4d,5a,5b)。说明葱属植物基因组中普遍存在与硫代谢相关的基因的独立扩张和分化,这可能与葱属植物特有的辛辣风味进化有关。
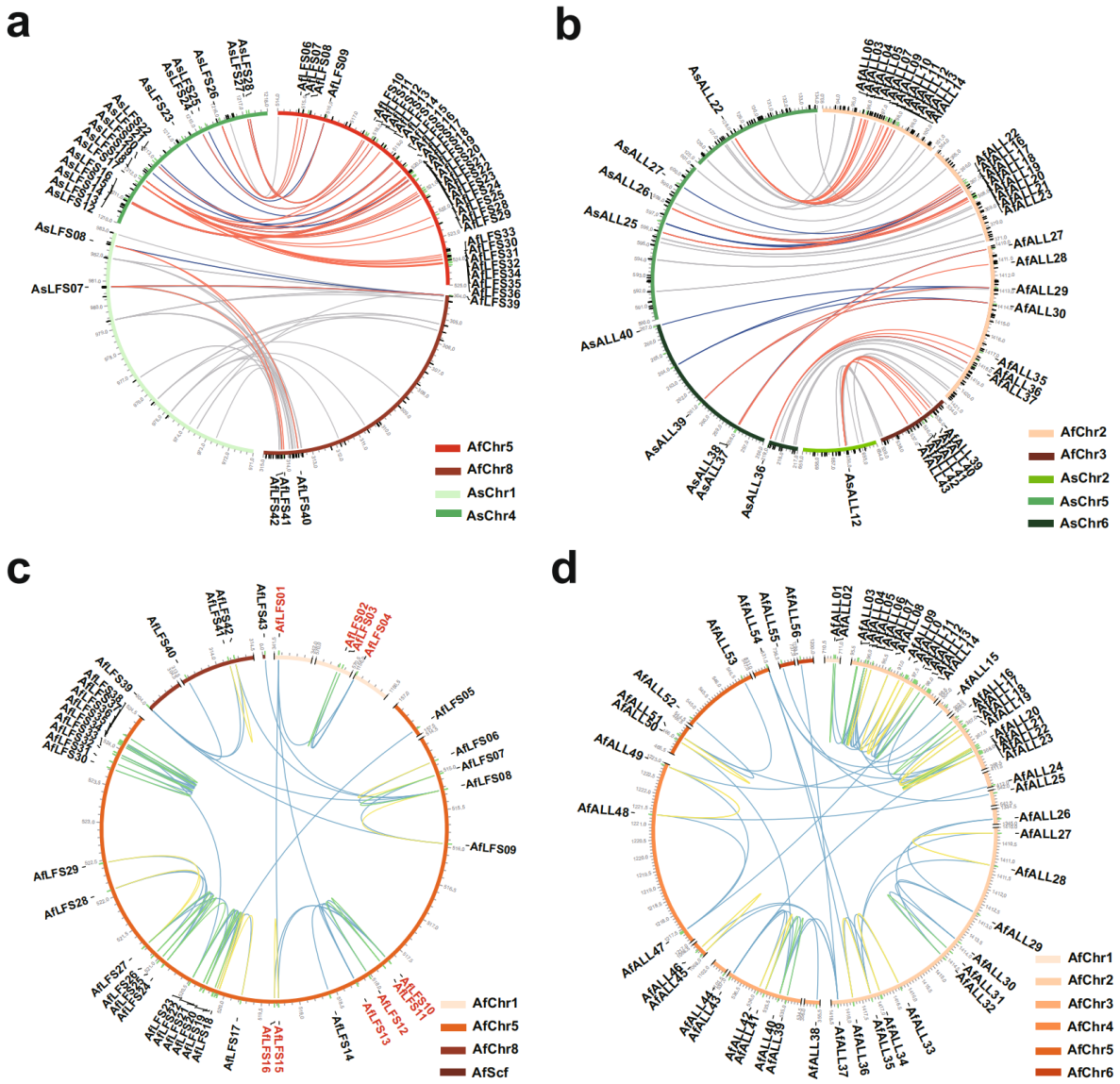
图5葱和大蒜中LFS和ALL基因家族的独立扩张
5、A. fistulosum的种群结构重测序研究
该研究对135份不同的葱属植物进行了重测序,以阐明A. fistulosum作物的系统发育关系。135份葱属植物的进化树显示了4个主要聚类中国红洋葱(A. cepa var. proliferum),青葱(A. ascalonicum),A. fistulosum Group1,和A. fistulosum Group2(图6a)。所有9个中国红洋葱和A. altaicum紧密地聚集在一组。22个青葱聚集在一起,显示出两个不同的亚群,而其余2个青葱则接近中国红洋葱群(图6a)。
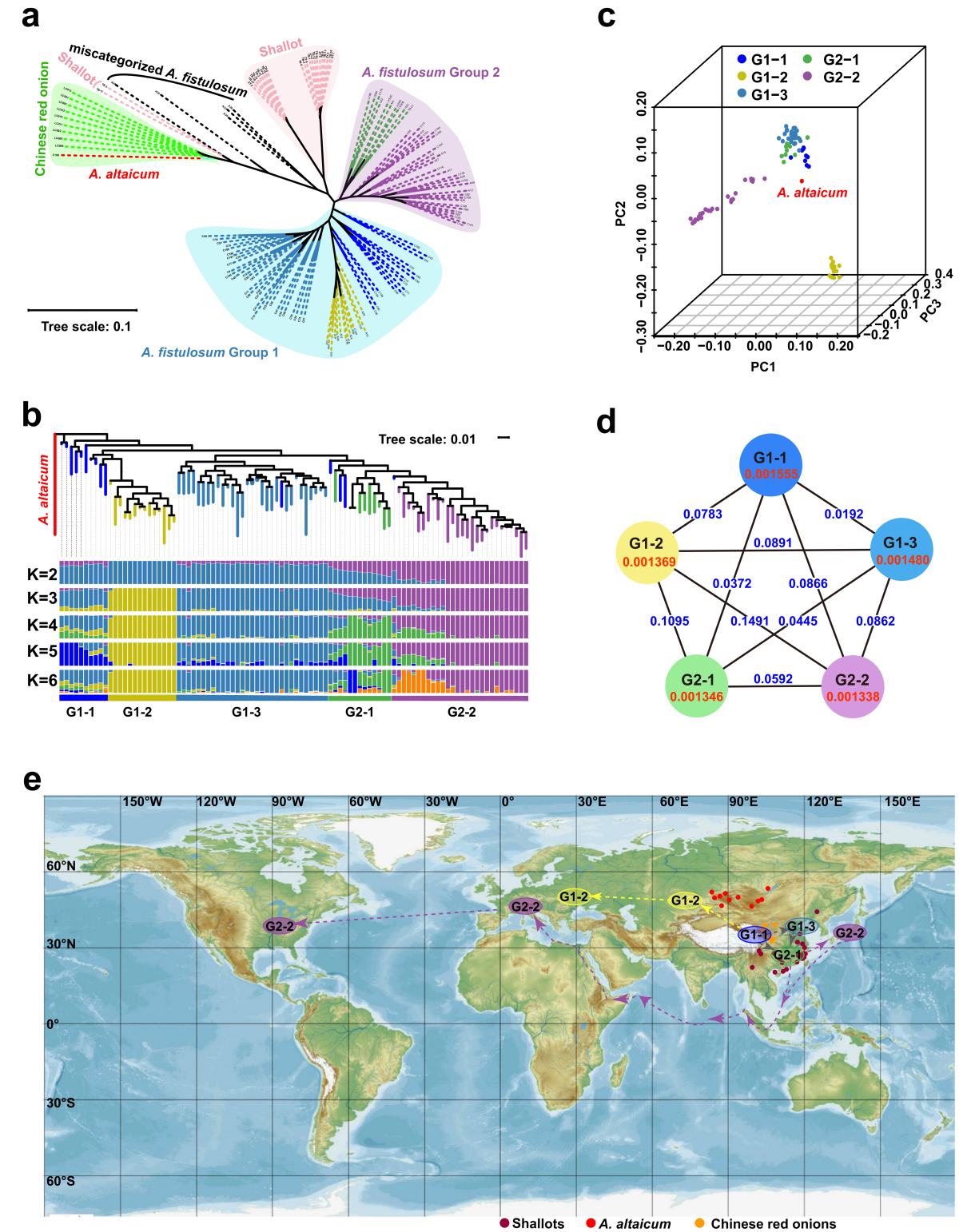
图6 A. fistulosum的种群结构和传播路线
96份A. fistulosum样本可分为5个亚组,并可归为2个组(图6a、b)。G1根据种群结构可分为3个地理分布不同的亚群。G1-1主要分布在中国西部,G1-2主要分布在中亚和俄罗斯,G1-3主要分布在中国北部和东北地区。G2也显示出两个可分化的地理亚群,其中来自中国东南部的材料聚集在G2-1亚群中,而分布在日本、美国和欧洲的材料具有较高的基因组相似性,聚类为G2-2(图6b,e)。
6、A. fistulosum基因组中的异蒜氨酸变异信号
该研究定量分析了91份A. fistulosum材料的异蒜氨酸(isoalliin)含量,以确定异蒜氨酸变异的基因组基础。G1-2材料的异蒜氨酸含量显著高于G1-3材料(图7a)。进一步分析发现,一些硫风味形成相关基因,如AfGSH2、AFFFMO3、AfGGT3、AfALL48、AfALL49、AfALL55和AfLFS11在G1-2中被选择。AfPCS1和AfALL42在G1- 3中被选择(图7b)。此外,在6个异蒜氨酸含量差异显著的品种叶片组织中,内源异蒜氨酸含量与几个ACSO-生物合成或水解基因的表达水平呈正相关,其中AfGSH2和AfPCS1的相关性最高(图7c)。
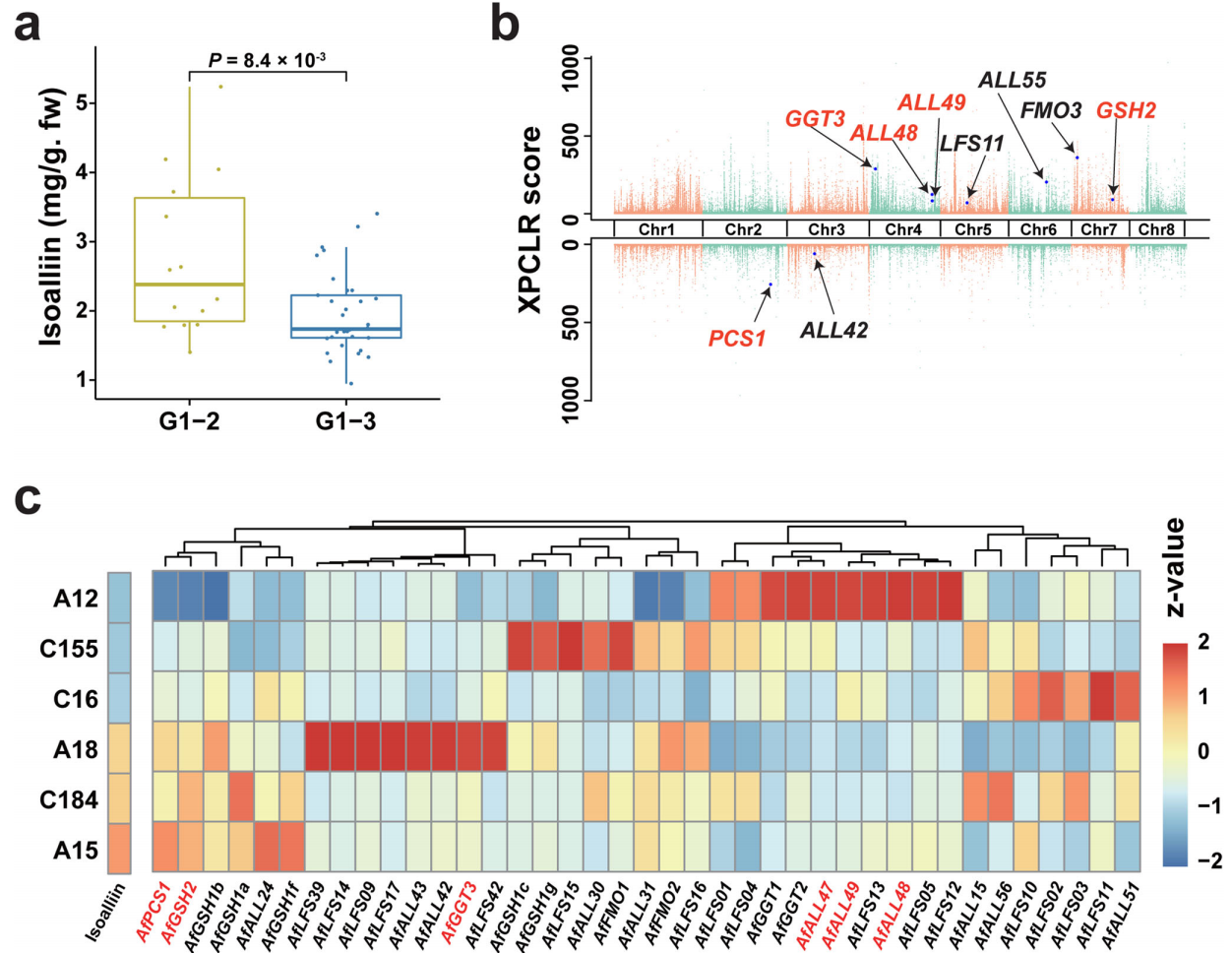
图7 葱中异蒜氨酸积累的变化研究
在25个风味形成相关基因高表达的低异蒜氨酸材料(A12、C155和C16)中,鉴定出19个ACSOs水解相关基因(ALL和LFS),这意味着弱生物合成和强水解都可能导致其低异蒜氨酸积累。在这19个ACSOs水解相关基因中,作者观察到6份材料中LFS或ALL基因的差异表达模式(图7c),这意味着ACSOs水解相关基因的广泛扩张,可能为葱中异蒜氨酸含量的变化提供更多进化机会。
总结
该研究通过组装染色体水平葱基因组,揭示葱属基因组的LTR不均匀爆发导致了其基因组成分的多样性,而散在重复事件很可能是葱属植物基因组扩张的原因。通过基因组、转录组等联合分析,发现蒜氨酸酶(alliinase)和催泪因子合成酶(lachrymatory factor synthase)的广泛复制和分化是葱属植物风味形成过程中的重要进化事件。此外,该研究还揭示了中国是葱的起源和驯化中心,为葱属植物的基因组进化、风味形成和驯化历史提供了见解,并为葱属植物分子育种提供了强大基础。
参考文献:
Liao, N. et al. Chromosome-level genome assembly of bunching onion illuminates genome evolution and flavor formation in Allium crops. Nat Commun, 2022.
 027-62435310 |
027-62435310 |
 service@speedracings.com |
service@speedracings.com |



