Cell Death & Disease | Direct RNA测序揭示HBV利用m5C修饰机制逃逸宿主天然免疫
英文标题:Epigenetic addition of m5C to HBV transcripts promotes viral replication and evasion of innate antiviral responses
发表时间:2024.1
发表期刊:Cell Death & Disease
IF:9.0
发表单位:武汉大学病毒学国家重点实验室朱帆研究组和中国科学院武汉病毒研究所关武祥研究组
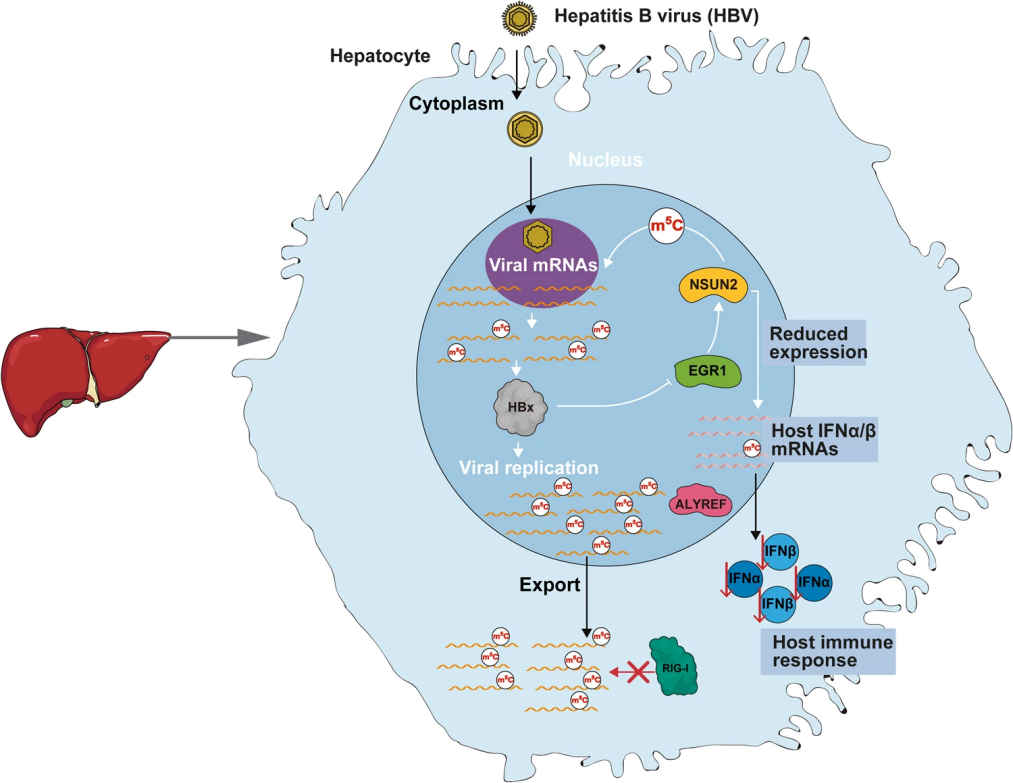
真核生物内的5-甲基胞嘧啶(m5C)作为关键调控因子,在RNA代谢过程中发挥着重要作用,尤其是在病毒RNA剪接、稳定和翻译方面。然而,m5C在乙肝病毒(HBV)复制过程中的作用尚未明晰。该研究聚焦于m5C在HBV复制中的具体功能,发现HBV mRNA中特定的m5C位点(如nt 1291)对病毒mRNA输出、HBx蛋白翻译及干扰素-β(IFN-β)抑制具有重要作用。NSUN2酶是催化m5C修饰的关键酶,但其活性受HBx蛋白转录水平的调控,这种调控是通过HBx蛋白影响EGR1与NSUN2基因启动子区域的相互作用实现的。此外,NSUN2的表达与宿主细胞内I型干扰素mRNA的m5C含量紧密相关,进而调控干扰素表达。
该研究表明,通过调控NSUN2表达可改变HBV mRNA的m5C修饰,并降低宿主IFN mRNA的m5C水平,这在HBV生命周期中起着关键作用。这些新发现揭示了HBV如何通过m5C调控机制来抑制IFN反应,并为开发基于IFN-α的新型治疗策略提供了指导。
本研究中,作者借助Nanopore Direct RNA测序可从单碱基水平鉴定m5C等RNA甲基化修饰位点这一优势,通过Direct RNA测序,成功鉴定到多个对病毒复制至关重要的m5C位点,为研究HBV调控宿主m5C修饰提供了有效数据。
主要结果
1.HBV中的m5C修饰对于病毒复制至关重要
作者首先在稳定转染HBV ayw株的HepG2.2.15细胞中进行了m5C-RIP实验。结果显示HBV mRNA在m5C特异性抗体富集下显著增加(图1A)。随后,采用纳米孔直接RNA测序(Direct RNA Sequencing)对从HepG2.2.15细胞中的Poly(A)+ RNA进行测序,成功鉴定到四个m5C位点(m5C-705、m5C-1204、m5C-1235和m5C-1291;图1B)。并在AAV-HBV转导小鼠肝脏RNA的Direct RNA测序数据中也证实了m5C-1204和m5C-1291的存在。同时对转染HBV 1.1-mer的细胞进行亚硫酸氢盐测序(BS-seq),也检测到m5C-1204、m5C-1235和m5C-1291位点,并发现它们周围无明显碱基偏好性(图1C)。
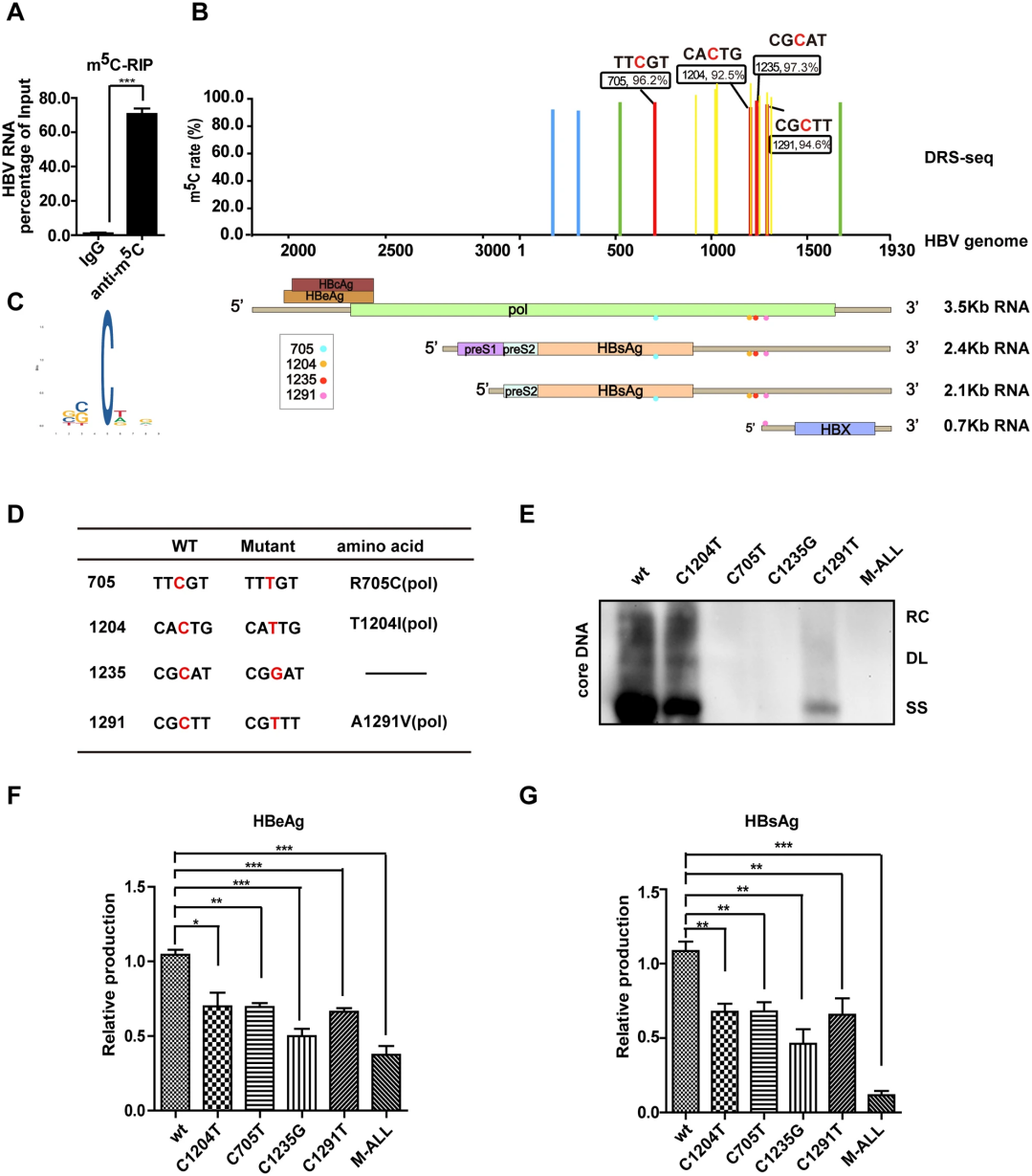
图1 在HBV mRNA中鉴定出对病毒复制至关重要的m5C位点
随后,为探究m5C在HBV生命周期中的作用,研究人员针对已鉴定的四个m5C位置设计并构建了含有非同义突变的HBV基因组突变体(图1D)。Southern blot结果揭示,所有突变体的病毒DNA复制能力均有所下降(图1E)。ELISA定量检测显示,这些突变体分泌的HBeAg和HBsAg量显著低于野生型HBV,特别是M-ALL突变体表现出明显的协同抑制效应(图1F、G)。表明HBV mRNA中的m5C具有促进HBV复制的功能。
HBV m5C-1291促进病毒RNA输出和翻译并抑制RIG-I识别作者特别关注了HBV编码的四种mRNA中普遍存在的m5C-1291位点,该位点位于0.7 kb mRNA的5'-UTR区,并进行了进一步的功能性探究。RIP实验和分馏实验结果显示,ALYREF蛋白作为m5C 识别蛋白能够与HBV mRNA结合,并促进含m5C RNA的输出(图2A,B)。过表达ALYREF可以增强核内HBV mRNA向胞质输出(图2C)。
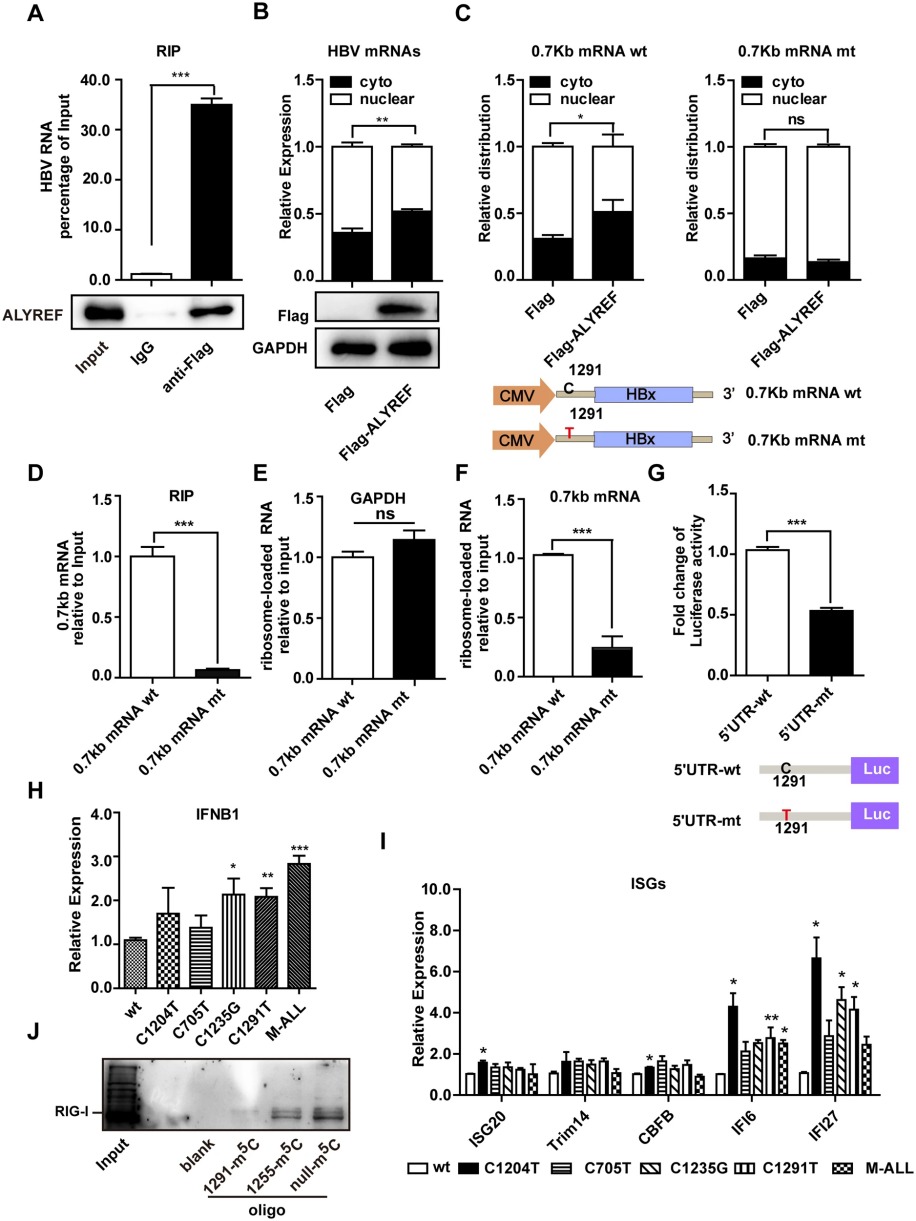
图2 HBV mRNA上的m5C-1291位点促进了病毒RNA的输出和翻译,并阻止了RIG-I对病毒RNA的识别
为了研究m5C-1291对HBx蛋白翻译的重要性,通过核糖体加载实验发现,相较于突变型0.7 kb mRNA,核糖体更倾向于结合到含有m5C-1291的野生型0.7 kb mRNA上,其结合量约为突变型的4倍(图2F)。此外,荧光素酶报告实验结果显示,野生型5′-UTR的荧光素酶活性高出突变型的两倍(图2G)。表明,HBV m5C-1291能够促进0.7 kb mRNA的翻译。
m5C修饰能够抑制Toll样受体(TLR)和RIG-I引发的先天免疫信号传导。研究发现,m5C-1291突变后,细胞经poly I:C处理时,IFN-β及某些ISG mRNA表达上调(图2H,I)。m5C-1291位于0.7 kb mRNA 5′-UTR形成的二级结构茎区,可能影响RIG-I识别。RNA pull down实验证明,未修饰的RNA寡核苷酸与RIG-I的相互作用强于m5C修饰的寡核苷酸(图2J),表明m5C-1291对于病毒RNA逃避RIG-I识别具有关键作用。
2.HBx与EGR1相互作用,下调NSUN2启动子活性
由于HBV不编码甲基转移酶,因此作者使用Western blot检测了宿主细胞中m5C 甲基化转移酶(NSUN2和DNMT2)以及识别蛋白(ALYREF和YBX1)的表达。结果显示,在携带HBV的HepG2.2.15细胞中,NSUN2表达显著降低,而ALYREF表达增加(图3A)。在瞬时转染HBV 1.1-mer的Huh7细胞中也观察到NSUN2表达量下降,并且整体m5C水平下降(图3B)。
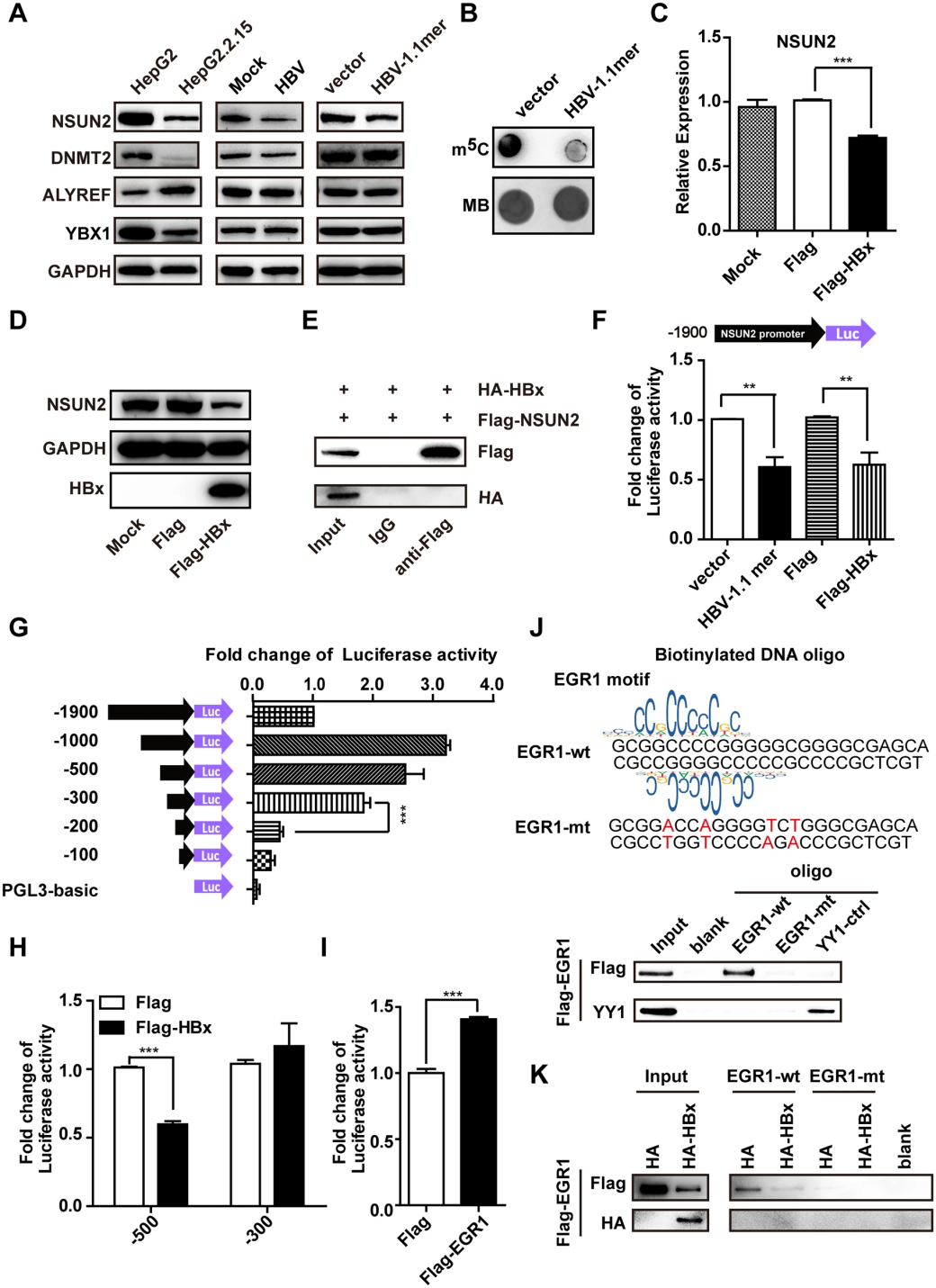
图3 HBV感染通过HBx和EGR1下调NSUN2的表达
为了探究NSUN2下调的原因,研究者分别过表达了HBV的三种主要蛋白HBs、HBc和HBx,并发现只有HBx过表达导致NSUN2 mRNA和蛋白质水平降低(图3C,D)。然而,免疫共沉淀(Co-IP)实验表明,HBx并未直接与NSUN2相互作用,且不会影响NSUN2 mRNA稳定性(图3E)。
鉴于HBx是已知的转录调控因子,研究者假设NSUN2的表达是由HBx在转录水平上调控的。通过构建包含NSUN2启动子区域的荧光素酶报告载体,证实HBV 1.1-mer转染或HBx表达能够降低NSUN2启动子活性(图3F)。进一步分析启动子序列发现,在−500至−300 nt区域内可能存在响应HBx的元件。结合JASPAR数据库分析,推测EGR1可能与启动子中的特定GC富集区域结合。DNA pull down实验发现,EGR1确实与第二个富含GC的motif结合,但HBx会降低EGR1的表达和结合能力,从而抑制NSUN2启动子活性。
3.NSUN2作为HBV m5C的甲基转移酶,同时抑制HBV感染
为了确定哪种甲基转移酶负责在HBV mRNA上添加m5C,我们通过RIP实验发现HBV mRNA仅与NSUN2相互作用。NSUN2过表达可以增加HBV mRNA的总体m5C水平,而抑制NSUN2则导致m5C水平降低(图4B,C)。而改变DNMT2表达对HBV mRNA的m5C水平无显著影响。此外,带有突变的无法有效催化胞嘧啶甲基化的NSUN2 C321A突变体在m5C-RIP实验中表现不佳(图4D)。值得注意的是,无论是短暂转染还是稳定转染HBV的情况下,NSUN2在细胞核内的定位并不改变。证实了NSUN2直接结合HBV mRNA,并在肝细胞核内催化胞嘧啶甲基化。
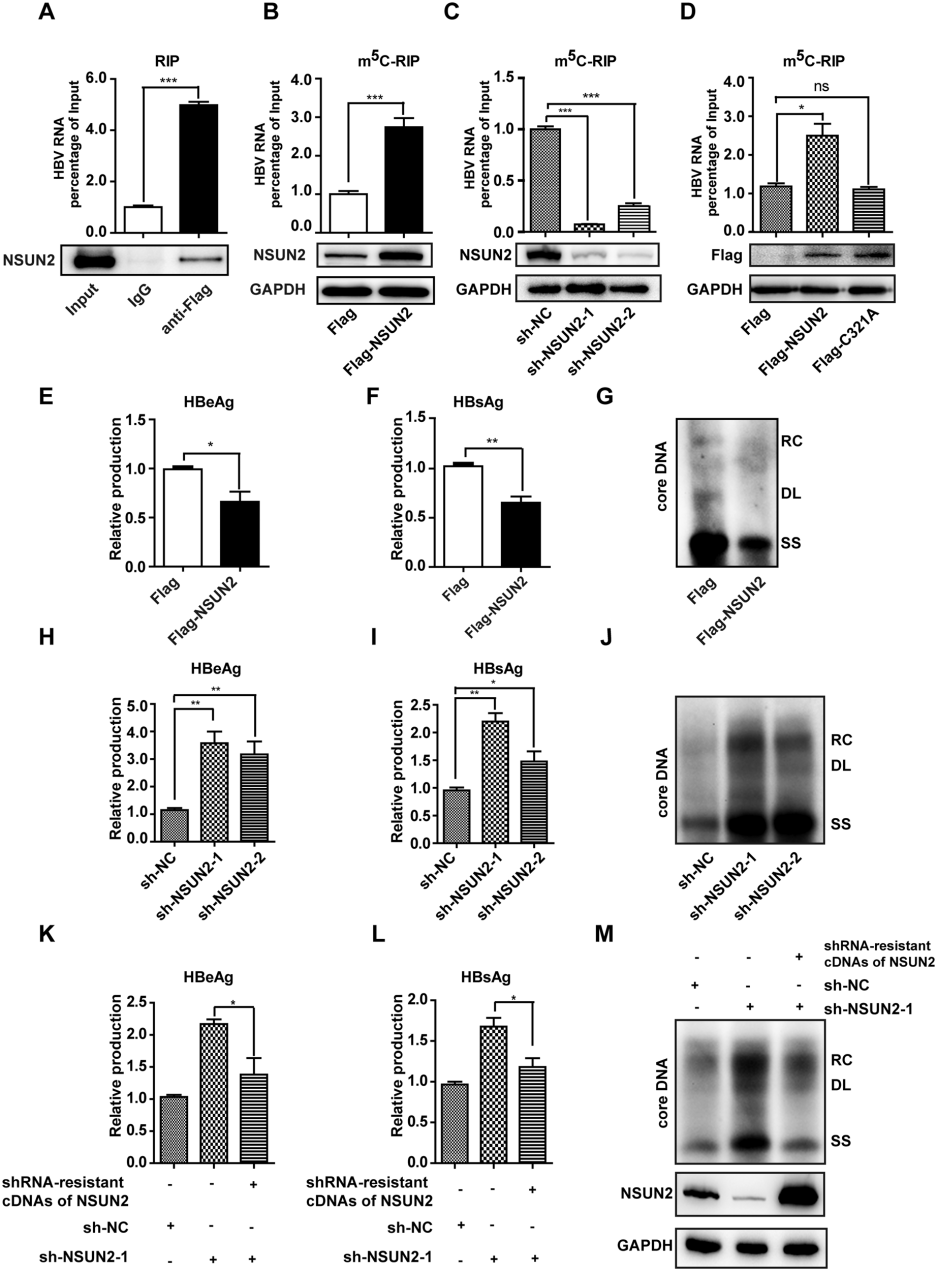
图4 NSUN2是HBV m5C 的甲基转移酶,可抑制HBV的感染
基于宿主RNA修饰酶在病毒复制中的关键作用,研究者深入探究了NSUN2在HBV生命周期中的功能。结果显示,NSUN2过表达会减少HBeAg和HBsAg分泌,并抑制核心相关DNA(包括松弛环状DNA、双链线性DNA和单链DNA)(图4E-G)。反之,敲低NSUN2会导致抗原分泌增强及病毒复制增强。恢复NSUN2表达后,这些效应发生逆转(图4H-M)。因此,虽然NSUN2促进了HBV mRNA上的m5C添加,但它也抑制了HBV的复制。
4.NSUN2表达的微妙平衡抑制IFN产生
为了研究NSUN2如何抑制HBV复制,研究者通过BS-Seq分析了HBV 1.1-mer转染细胞中整体m5C水平的变化。结果显示m5C修饰主要位于5′-UTR区域,并且在CDS和3′-UTR区域分布下降,共鉴定到20,148个差异甲基化区域(DMRs)(图5A,B),其中与先天免疫反应相关基因如IRF3、IFNB1等的m5C水平发生了显著变化。
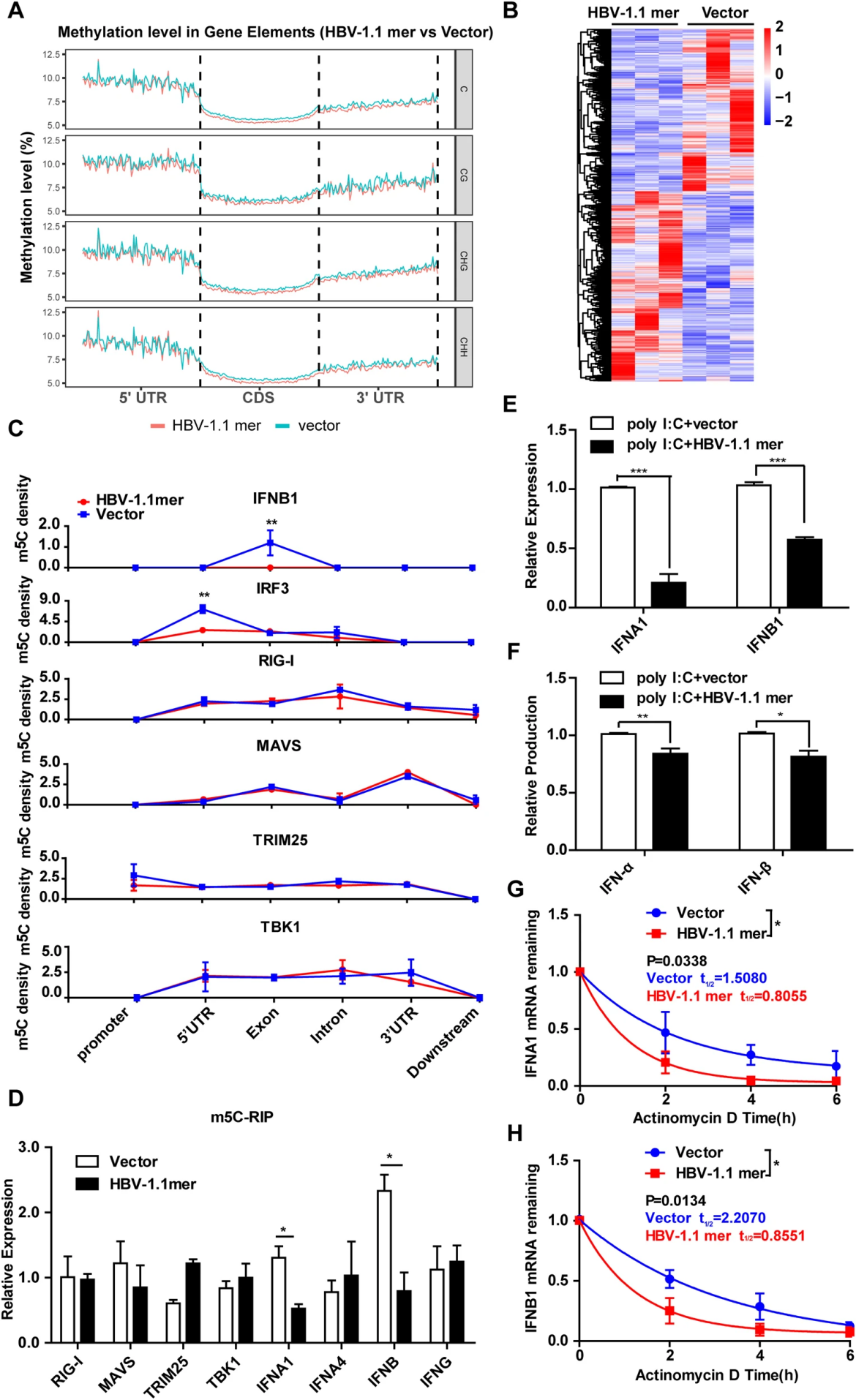
图5 HBV感染降低干扰素相关基因 m5C 水平
分析与RIG-I信号通路相关的分子,例如IRF3和IFNB1,发现在IRF3的5′-UTR区和IFNB1的外显子区,显示出m5C分布明显减少(图5C),m5C-RIP证实IFNA1和IFNB1 RNA的m5C水平也有所减少(图5D)。此外,HBV转染降低了poly I:C诱导的IFNA1和IFNB1 mRNA以及相应蛋白质的产生(图5E,F),暗示HBV转染通过降低m5C水平和RNA稳定性,抑制I型干扰素的产生。
尽管在HBV患者体内I型干扰素水平极低但下调机制不明,作者通过调控NSUN2表达来探究其对干扰素产生的影响。实验结果表明,NSUN2敲低会减少IFN-α和IFN-β的生成,而NSUN2过表达则能增加这两种干扰素的产生(图6A-D)。在HBV转染细胞中恢复NSUN2表达可以恢复被抑制的IFN-α和IFN-β生成,同时恢复了ISGs表达水平(图6F-H)。总之,IFN-α和IFN-β的产生与它们mRNA的m5C水平及NSUN2的表达量紧密相关。
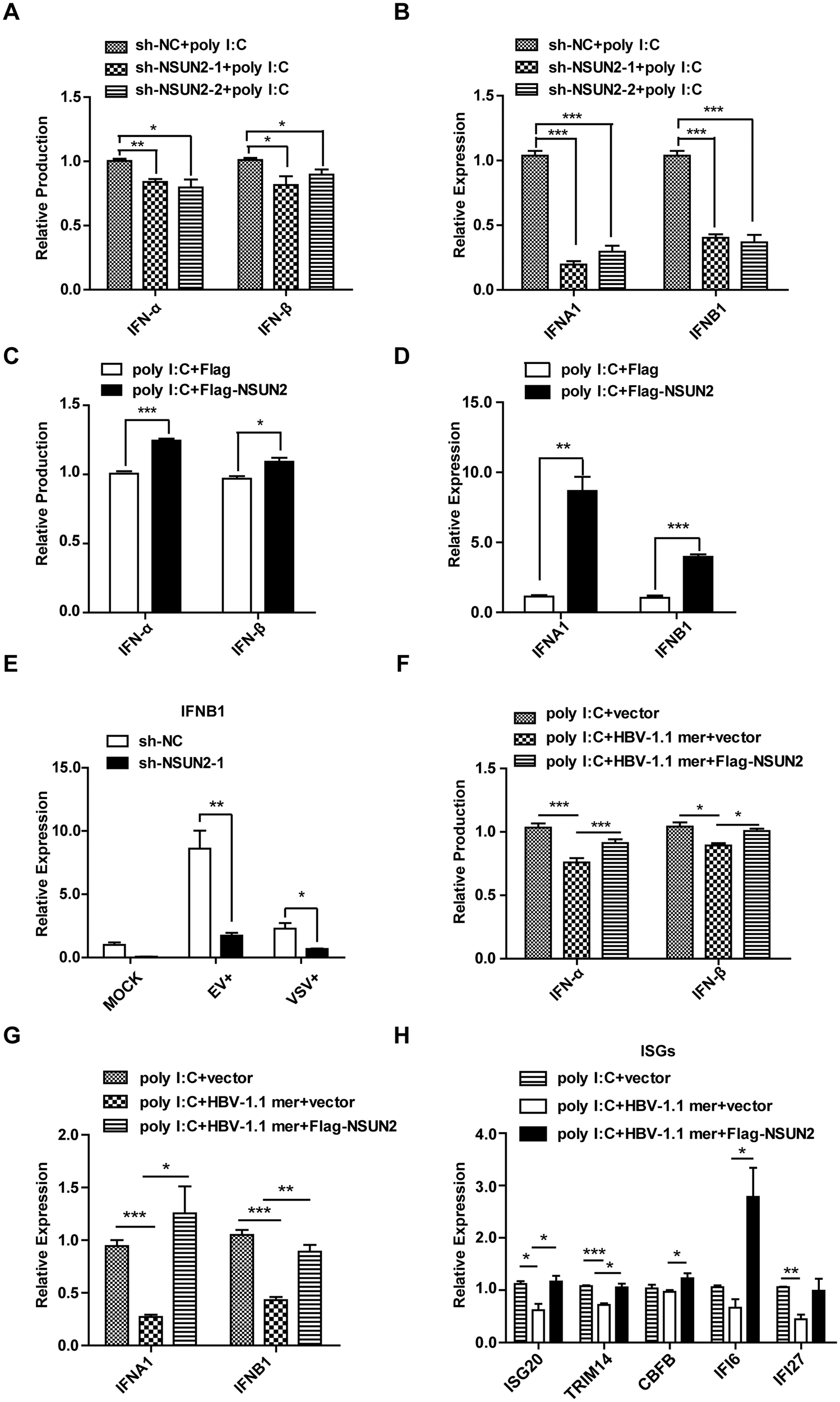
图6 NSUN2是poly I:C诱导下IFN-α和IFN-β生成的正调节因子
总结
本研究探讨了m5C及其甲基转移酶NSUN2在HBV诱导的先天免疫应答中的作用,并证实NSUN2表达的微妙平衡对于HBV生命周期至关重要。当NSUN2表达减少时,有利于维持HBV mRNA上的m5C修饰,进而促进病毒感染的有效进行;同时,这种下调并不会导致I型干扰素(IFN) mRNA中m5C含量增加,从而避免IFN表达被诱导激活。
参考文献:
Ding, S., Liu, H., Liu, L. et al. Epigenetic addition of m5C to HBV transcripts promotes viral replication and evasion of innate antiviral responses. Cell Death Dis 15, 39 (2024).
下载链接:
//doi.org/10.1038/s41419-023-06412-9
 027-62435310 |
027-62435310 |
 service@speedracings.com |
service@speedracings.com |



