揭秘病毒生命周期的分子细节:Direct RNA测序技术的全面应用
Direct RNA测序 (直接RNA测序或DRS) 基于Nanopore测序平台,不经反转录、无需扩增,直接读取全长转录本,无测序偏好性。可以检测单个RNA分子上单碱基的m6A、m5C和假尿苷等RNA修饰位点;能准确分析可变剪切、APA、融合基因和鉴定新转录本;此外,还可对单个RNA分子的Poly(A)长度进行相对准确的估算,还原真实的RNA特征。
DRS是一种革命性的高通量测序技术,在病毒研究中展现出了独特的优势,尤其是在探索病毒生命周期、变异监控、宿主-病毒互作以及病毒基因表达的复杂性方面。具体表现在以下几个方面:
01
病毒基因组结构与变异分析:
DRS能够捕获RNA病毒的完整转录本,包括其可能存在的剪接变异体和结构变异,有助于揭示病毒的遗传多样性及其进化动态。这对于监测病毒如SARS-CoV-2等的突变非常重要,这些突变可能影响病毒的传播能力、致病性和对抗病毒药物及疫苗的敏感性。
02
病毒转录本异构体分析:
许多病毒具有复杂的转录调控机制,产生不同长度或剪接形式的mRNA。DRS可以直接检测到这些转录本异构体,帮助理解它们在病毒生命周期和致病机理中的作用。
03
宿主-virus相互作用研究:
通过同时捕获宿主细胞和病毒的RNA,DRS技术能够揭示病毒感染期间宿主转录组的变化,包括宿主防御机制的激活、细胞因子反应以及病毒可能利用或抑制的宿主途径,这对于发现新的治疗靶点至关重要。
04
病毒RNA修饰分析:
某些RNA病毒的RNA分子上存在甲基化、假尿嘧啶化等修饰,这些修饰可能影响病毒RNA的稳定性、翻译效率或逃避宿主免疫识别。DRS技术能够在一定程度上保留并检测这些化学修饰信息,有助于深入理解病毒的生存策略。
05
感染动力学研究:
通过追踪特定病毒RNA序列在不同时间点的丰度变化,DRS可以帮助描绘病毒在宿主体内的复制和扩散动态,为了解病毒感染进程提供时间分辨率更高的数据。
下面小编将分享几篇DRS技术在病毒研究中的具体案例,希望为大家带来病毒研究的新思路。
案例一 使用Direct RNA测序揭示SARS-CoV-2转录结构的复杂性
文章题目:The Architecture of SARS-CoV-2 Transcriptome
发表期刊:Cell
IF:66.85
发表时间:2020.5
SARS-CoV-2是一种引发COVID-19大流行的新型冠状病毒。尽管SARS-CoV-2的基因组近期已被报道,但其转录组结构仍未知。该研究使用两种互补的测序技术(DRS和DNB-seq),构建了SARS-CoV-2转录组和表观转录组的高分辨率图谱。除基因组RNA和9种亚基因组RNA外,SARS-CoV-2还能产生编码未知开放阅读框(ORFs)的转录本,这些ORFs可能涉及融合、缺失或移码现象。使用DRS鉴定到病毒转录本上至少有41个RNA修饰位点,其中最频繁出现的motif为AAGAA。与未修饰的RNA相比,被修饰的RNA具有更短的Poly(A)尾巴,提示这种修饰与3'端尾巴之间存在关联。对该研究中发现的未知转录本和RNA修饰进行功能研究,将为我们理解SARS-CoV-2的生命周期及其致病机理开辟新的研究方向。

图1 Direct RNA测序揭示SARS-CoV-2转录结构的复杂性
案例二 对全长HIV-1 RNA进行的单分子表观转录组分析揭示了特定位置m6A的功能
英文标题:Single-molecule epitranscriptomic analysis of full-length HIV-1 RNAs reveals functional roles of site-specific m6As
发表期刊:Nature Microbiology
IF:28.3
发表时间:2024.4
尽管化学修饰对RNA的重要性已经得到人们认可,但这些修饰在人类免疫缺陷病毒(HIV-1)复制过程中的进化优势和具体作用仍不清楚。大多数研究仅提供了低分辨率下片段化RNA修饰的群体平均值,并且依赖于通过干扰宿主效应因子来间接分析表型效应。该研究使用DRS方法,在全长、单个RNA水平和单核苷酸分辨率上分析了HIV-1 RNA上的化学修饰。结果显示,HIV-1的修饰意外地简单,重点揭示了3′末端附近的三个关键的N6-甲基腺苷(m6A)修饰。这些m6A修饰在剪接的病毒mRNA中比在基因组RNA中更密集,在维持HIV-1 RNA正常剪接和翻译水平方面发挥着关键作用。同时发现HIV-1产生具有不同m6A组合的多种RNA亚种,通过保持多种m6A模式增强其稳定性和适应性,提出了一种基于RNA水平的新型病毒进化策略。总之,该研究不仅强调了HIV-1 RNA中m6A修饰的保守性和对病毒生命周期的关键作用,还为深入理解病毒RNA的表观遗传调控机制及未来开发针对性治疗策略提供了新的科学依据。
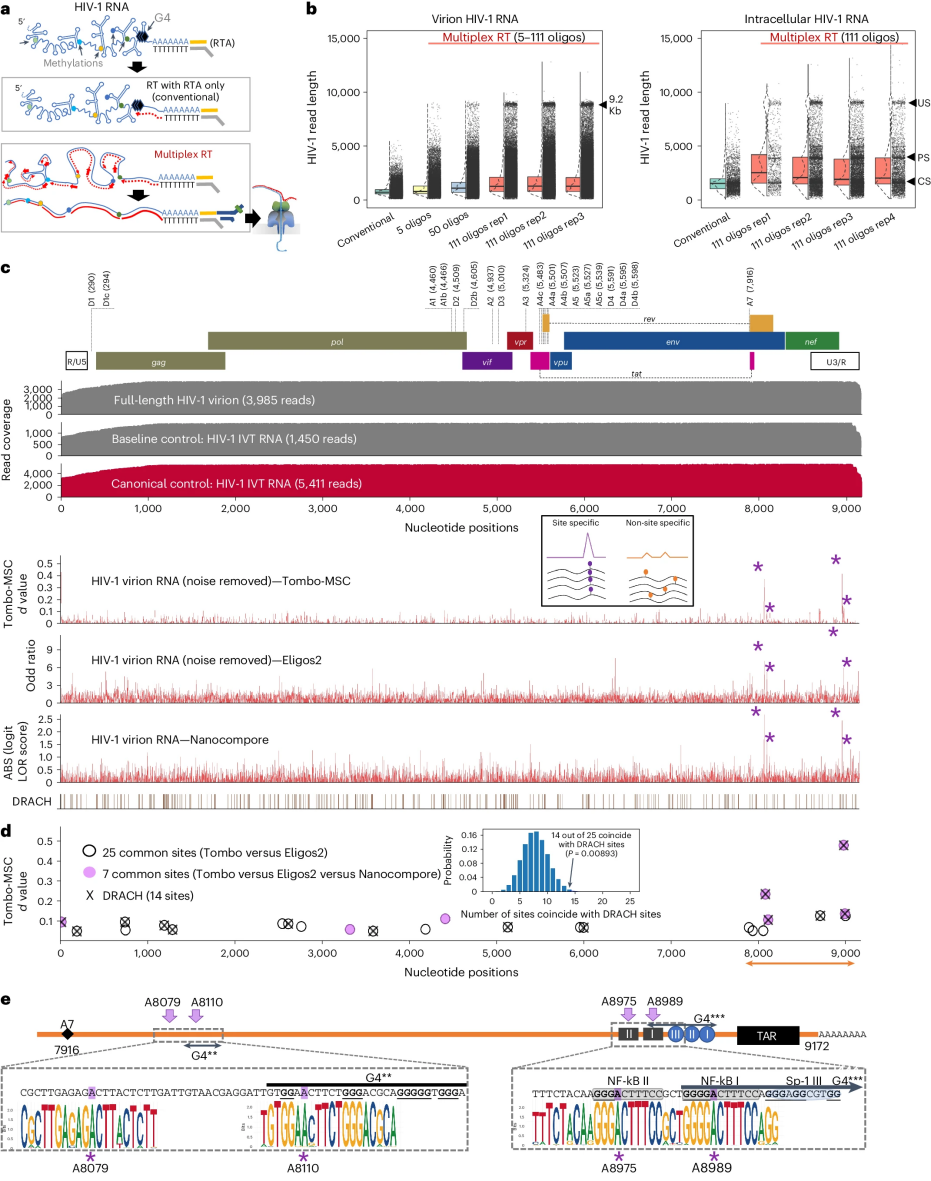
图2 全长HIV-1 RNA的DRS表明了m6A位点的特异性功能
案例三 Direct RNA测序能够消除传统抗体方法检测RNA病毒m6A修饰的假阳性问题
文章标题:N6-methyladenosine modification is not a general trait of viral RNA genomes
发表杂志:Nature Communications
IF:16.6
发布时间:2024.3
尽管大多数m6A修饰发生于细胞核内,但是已有研究表明,诸如基孔肯雅病毒(Chikungunya virus, CHIKV)和登革热病毒(Dengue virus, DENV)等多种仅在细胞质中复制的RNA病毒,其基因组也广泛存在m6A修饰现象。然而,先前的研究大多基于m6A-Seq技术,这种技术依赖于抗体,存在高假阳性率的问题。为了验证胞质RNA病毒CHIKV和DENV是否具有m6A修饰,本研究采用不依赖于抗体的SELECT技术和DRS技术,结合多种功能及分子验证方法,对CHIKV和DENV的m6A修饰进行了全面的分析。研究结果显示,在CHIKV和DENV RNA中并未发现支持m6A修饰的证据,并且敲低宿主m6A修饰酶不影响病毒感染进程,同时证实病毒感染不会改变核内m6A修饰。该研究反驳了m6A修饰普遍存在于胞质RNA病毒的观点,并强调利用多种技术验证RNA修饰的必要性。
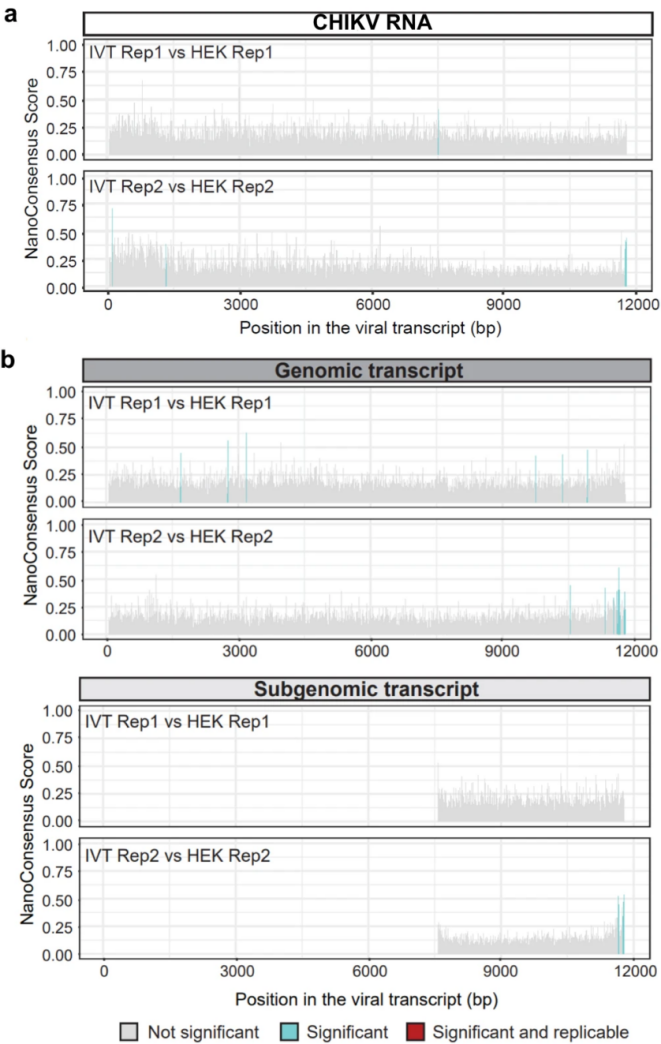
图3 CHIKV RNA的DRS分析没有检测到抗体依赖性m6A peak内的修饰
案例四 Direct RNA 测序揭示了腺病毒 RNA 上的 m6A 修饰是有效剪接所必需的
英文标题:Direct RNA sequencing reveals m6A modifications on adenovirus RNA are necessary for efficient splicing
发表期刊:Nature Communications
IF:14.919
发表时间:2020.11
腺病毒是一种依赖宿主RNA加工机制的核复制的DNA病毒。细胞RNA的加工与代谢可受METTL3调控,该酶可催化在mRNA上添加N6-甲基腺嘌呤(m6A)。尽管此前已检测到m6A修饰的腺病毒RNA,但在感染周期中该修饰的位置和功能尚不清楚。由于复杂的腺病毒转录组包含重叠的剪接单元,这会阻碍短读长测序准确定位m6A修饰位点,该研究采用MeRIP-seq与DRS相结合的方法,以检测腺病毒转录组的m6A修饰。尽管早期和晚期病毒转录本均含有m6A,但m6A甲基转移酶METTL3的缺失,特异性影响了病毒晚期转录本的表达,降低了转录本的剪接效率。该研究使用了DRS技术,这是一种能够在单个转录本水平实现单核苷酸分辨率m6A修饰的新技术。并强调了m6A在调控病毒病原体剪接中的作用。

图4 使用Direct RNA测序进行m6A检测的统计学框架
案例五 Direct RNA测序揭示乙型肝炎病毒通过调控宿主m5C修饰逃逸宿主抗病毒天然免疫的作用机制
英文标题:Epigenetic addition of m5C to HBV transcripts promotes viral replication and evasion of innate antiviral responses
发表期刊:Cell Death & Disease
发表时间:2024.1
真核生物内的5-甲基胞嘧啶(m5C)作为关键调控因子,在RNA代谢过程中发挥着重要作用,尤其是在病毒RNA剪接、稳定和翻译方面。然而,m5C在乙肝病毒(HBV)复制过程中的作用尚未明晰。该研究聚焦于m5C在HBV复制中的具体功能,发现HBV mRNA中特定的m5C位点(如nt 1291)对病毒mRNA输出、HBx蛋白翻译及干扰素-β(IFN-β)抑制具有重要作用。NSUN2酶是催化m5C修饰的关键酶,但其活性受HBx蛋白转录水平的调控,这种调控是通过HBx蛋白影响EGR1与NSUN2基因启动子区域的相互作用实现的。此外,NSUN2的表达与宿主细胞内I型干扰素mRNA的m5C含量紧密相关,进而调控干扰素表达。
该研究表明,通过调控NSUN2表达可改变HBV mRNA的m5C修饰,并降低宿主IFN mRNA的m5C水平,这在HBV生命周期中起着关键作用。这些新发现揭示了HBV如何通过m5C调控机制来抑制IFN反应,并为开发基于IFN-α的新型治疗策略提供了指导。
本研究中,作者借助Nanopore DRS技术可从单碱基水平鉴定m5C等RNA甲基化修饰位点这一优势,成功鉴定到多个对病毒复制至关重要的m5C位点,为研究HBV调控宿主m5C修饰提供了有效数据。
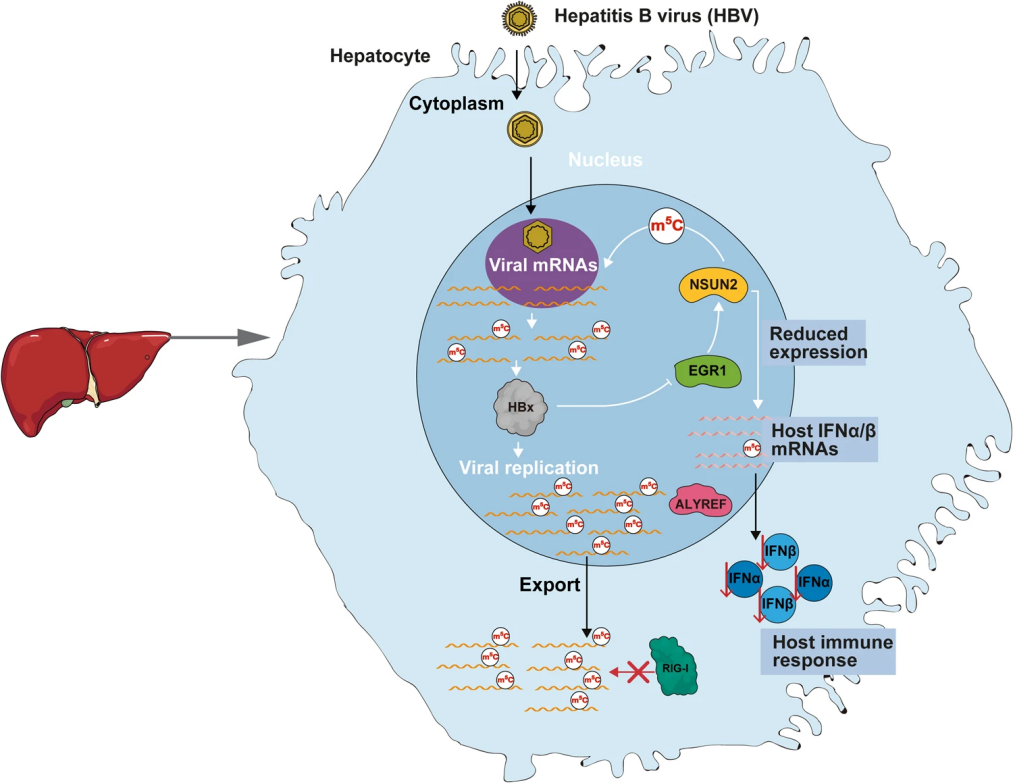
图5 HBV如何调节宿主RNA甲基转移酶NSUN2以促进其复制的模型图
案例六 DRS揭示PUS7介导的假尿苷修饰如何影响SARS-CoV-2 RNA基因组与宿主蛋白的特异性相互作用
英文标题:Unveiling the role of PUS7-mediated pseudouridylation in host protein interactions specific for the SARS-CoV-2 RNA genome
发表期刊:Molecular Therapy-Nucleic Acids
发表时间:2023.10
严重急性呼吸系统综合症冠状病毒2(SARS-CoV-2),是一种正链单股RNA病毒,在其生命周期中与宿主细胞蛋白发生复杂的相互作用。这些相互作用一方面使宿主能够识别并抑制病毒的复制,另一方面也促进了病毒转录、翻译和复制等基本过程。然而,病毒与宿主如何相互作用仍知之甚少。该研究采用了catRAPID算法,并结合基于质谱技术的RNA-蛋白相互作用检测方法,来预测并验证那些专门结合SARS-CoV-2 RNA高度结构化的5′端和3′端区域的宿主蛋白。在已识别的相互作用中,作者优先考虑了假尿嘧啶合酶PUS7,它能同时结合病毒RNA的两端。通过Nanopore DRS技术,发现病毒RNA经历了广泛的转录后修饰。在SARS-CoV-2 RNA的两个末端区域,包括病毒转录调控序列的引导序列中,鉴定了PUS7的修饰共识区域。总的来说,该研究为宿主蛋白与SARS-CoV-2非编码区的相互作用提供了新的认识,并突出了假尿嘧啶合酶和其转录后修饰在病毒生命周期中的潜在重要性。这一新知识加深了我们对病毒-宿主相互作用机制的理解,可能为开发针对性的治疗策略提供依据。

图6 PUS7介导的假尿苷修饰影响SARS-CoV-2 RNA基因组与宿主蛋白的特异性相互作用
参考文献:
1. Kim D, Lee JY, Yang JS, Kim JW, Kim VN, Chang H. The Architecture of SARS-CoV-2 Transcriptome. Cell. 2020.
2. Ding, S., Liu, H., Liu, L. et al. Epigenetic addition of m5C to HBV transcripts promotes viral replication and evasion of innate antiviral responses. Cell Death Dis 15, 39 (2024).
3. Baquero-Pérez, B., Yonchev, I.D., Delgado-Tejedor, A. et al. N6-methyladenosine modification is not a general trait of viral RNA genomes. Nat Commun 15, 1964 (2024).
4. Baek, A., Lee, GE., Golconda, S. et al. Single-molecule epitranscriptomic analysis of full-length HIV-1 RNAs reveals functional roles of site-specific m6As. Nat Microbiol (2024).
5. Price, A.M., Hayer, K.E., McIntyre, A.B.R. et al. Direct RNA sequencing reveals m6A modifications on adenovirus RNA are necessary for efficient splicing. Nat Commun 11, 6016 (2020).
6. Giambruno R, Zacco E, Ugolini C, et al. Unveiling the role of PUS7-mediated pseudouridylation in host protein interactions specific for the SARS-CoV-2 RNA genome. Mol Ther Nucleic Acids. 2023.
 027-62435310 |
027-62435310 |
 service@speedracings.com |
service@speedracings.com |



